Introducció als registres de càncer: diferència entre les revisions
(Diversos canvis en tota la pàgina de Introducció als registres de càncer) |
(S'han posat les referències bibliogràfiques de la Introducció a l’automatització dels registres de càncer) |
||
| Línia 33: | Línia 33: | ||
A partir de l’any 2018, la terminologia SNOMED CT emprada per codificar la topografia i la morfologia en els laboratoris d’anatomia patològica (AP) inclou els conceptes morfològics però no els codis esmentats anteriorment (M-8000/0 a M-9992/3). Per aquest motiu, el Pla director d’oncologia (PDO) ha creat un diccionari de neoplàsies de SNOMED CT i l’ha convertit a la ICD-O.3.2 i a la sèrie ''WHO Blue Books'' amb la finalitat d’identificar els casos candidats a ser registrats en un RCBP o RTH sota els criteris de la IARC i l’ENCR.<ref>Sanz X, Pareja L, Rius A, et al. How cancer registries can detect neoplasms in pathology laboratories that code with SNOMED CT terminology? An actual, simple and flexible solution. ''Int J Med Inform''. 2020;141(July 2019):104167. doi:10.1016/j.ijmedinf.2020.104167</ref> | A partir de l’any 2018, la terminologia SNOMED CT emprada per codificar la topografia i la morfologia en els laboratoris d’anatomia patològica (AP) inclou els conceptes morfològics però no els codis esmentats anteriorment (M-8000/0 a M-9992/3). Per aquest motiu, el Pla director d’oncologia (PDO) ha creat un diccionari de neoplàsies de SNOMED CT i l’ha convertit a la ICD-O.3.2 i a la sèrie ''WHO Blue Books'' amb la finalitat d’identificar els casos candidats a ser registrats en un RCBP o RTH sota els criteris de la IARC i l’ENCR.<ref>Sanz X, Pareja L, Rius A, et al. How cancer registries can detect neoplasms in pathology laboratories that code with SNOMED CT terminology? An actual, simple and flexible solution. ''Int J Med Inform''. 2020;141(July 2019):104167. doi:10.1016/j.ijmedinf.2020.104167</ref> | ||
= Introducció a l’automatització dels registres de càncer = | = Introducció a l’automatització dels registres de càncer = | ||
L’automatització és el disseny d’algorismes per substituir part dels processos manuals de presa de decisions del personal dels registres de càncer. | L’automatització és el disseny d’algorismes per substituir part dels processos manuals de presa de decisions del personal dels registres de càncer.<ref name=":9" /> La figura 1 il·lustra el flux de dades estàndard de resolució de casos de càncer d’un software d’automatització de registres.<ref name=":9" /> | ||
Un registre de càncer només es pot automatitzar si les '''fonts d’informació''' (altes hospitalàries, anatomia patològica, quimioteràpia, radioteràpia, mortalitat...) estan disponibles electrònicament. | Un registre de càncer només es pot automatitzar si les '''fonts d’informació''' (altes hospitalàries, anatomia patològica, quimioteràpia, radioteràpia, mortalitat...) estan disponibles electrònicament.<ref name=":9" /> El registre de càncer també ha de ser una font d’informació del registre mateix ja que permet identificar els tumors que ja han estat registrats anteriorment (tumors prevalents).<ref name=":9" /> Aquestes fonts d’informació han de proveir el registre de càncer del conjunt mínim de dades necessàries (taula 1). | ||
La integritat i la qualitat de les dades electròniques originals són crucials per determinar l’eficiència de l’automatització del registre de càncer. Una baixa qualitat de les fonts d’informació originals augmenta la proporció de diagnòstics discordants i disminueix l’eficiència de l’automatització atès que augmenta el nombre de casos que cal revisar manualment. | La integritat i la qualitat de les dades electròniques originals són crucials per determinar l’eficiència de l’automatització del registre de càncer. Una baixa qualitat de les fonts d’informació originals augmenta la proporció de diagnòstics discordants i disminueix l’eficiència de l’automatització atès que augmenta el nombre de casos que cal revisar manualment.<ref name=":9" /> Utilitzar múltiples fonts d’informació augmenta els casos que s’han de revisar, però disminueix la probabilitat de generar falsos positius, augmenta l’exhaustivitat i enriqueix la informació del registre.<ref name=":9" /><ref name=":10">Simonato L, Zambon P, Rodella S, et al. A computerised cancer registration network in the Veneto region, north-east of Italy: a pilot study. ''Br J Cancer''. 1996;73(11):1436-1439.</ref> | ||
de | És important adaptar-se al vocabulari emprat en els registres de càncer automatitzats: | ||
* '''Sumarització ''(patient level-matching):''''' procés pel qual les fonts d’informació electròniques són vinculades a un mateix individu. S’assigna a cada individu un número identificador intern. En un RTH, el número d’història clínica (HC) s’utilitza per lligar la informació de cada pacient a les diferents bases de dades.<ref name=":9" /><ref name=":10" /> | |||
* '''Consolidació ''(tumor level-matching):''''' els algorismes avaluen les dades de les fonts d’informació per de- terminar quins tumors presenta el pacient i sumaritzar les dades per a cada tumor.<ref name=":0" /><ref name=":1" /><ref name=":8" /><ref>International Agency for Research on Cancer, World Health Organization, International Association of Cancer Registries, European Network of Cancer Registries. ''International Rules for Multiple Primary Cancers (ICD-O Third Edition)''. International Agency for the Research on Cancer; 2004. http://www.iacr.com.fr/images/doc/MPrules_ july2004.pdf</ref> No hi ha algorismes estàndard definits, però els registres automatitzats es basen parcialment en els descrits més endavant. Els algoritmes tenen definits possibles motius de revisió que fan que un nombre determinat de casos s’hagin de resoldre manualment. La proporció de casos resolts automàticament oscil·la del 50% al 75% i la variabilitat és més atribuïble a la qualitat de les fonts d’informació que no pas al rendiment dels algorismes.<ref name=":9" /><ref name=":10" /><ref>Ribes J, Gálvez J, Melià A, Clèries R, Messeguer X, Bosch FX. Automatización de un registro hospitalario de tumores. | |||
''Gac Sanit''. 2005;19(3):221-228.</ref> Els possibles tumors múltiples són, sobretot, la causa principal de revisió '''('''figura 1''').'''<ref name=":9" /> | |||
L’automatització dels registres segueix els passos següents: i) recopilar les dades de les fonts d’informació, ii) estandarditzar la informació, iii) agrupar la informació del tumor (consolidació, ''tumor-level matching''), iv) omplir i codificar la topografia i morfologia tumorals segons la ICD-O-3.2.4 Un pacient pot tenir més d’un tumor (tumors múltiples) i la consolidació hauria d’agrupar la informació per a cada tumor '''('''figura 1''').''' | L’automatització dels registres segueix els passos següents: i) recopilar les dades de les fonts d’informació, ii) estandarditzar la informació, iii) agrupar la informació del tumor (consolidació, ''tumor-level matching''), iv) omplir i codificar la topografia i morfologia tumorals segons la ICD-O-3.2.4 Un pacient pot tenir més d’un tumor (tumors múltiples) i la consolidació hauria d’agrupar la informació per a cada tumor '''('''figura 1''').''' | ||
| Línia 52: | Línia 52: | ||
'''Figura 1. Flux de dades dels registres de càncer automatitzats''' | '''Figura 1. Flux de dades dels registres de càncer automatitzats''' | ||
[[Fitxer:Flux de dades dels registres de càncer automatitzats.png|cap|marc|Adaptació a partir de: <ref name=":0" /><ref>International Agency for Research on Cancer, European Network of Cancer Registries, Europe Against Cancer Programme of The European Commission. ''Automated Data Collection in Cancer Registration.'' (Black R, Simonato L, Storm H, Demaret E, ed.). IARC Technical Reports No. 32; 1998.</ref> | [[Fitxer:Flux de dades dels registres de càncer automatitzats.png|cap|marc|Adaptació a partir de: <ref name=":0" /><ref name=":9">International Agency for Research on Cancer, European Network of Cancer Registries, Europe Against Cancer Programme of The European Commission. ''Automated Data Collection in Cancer Registration.'' (Black R, Simonato L, Storm H, Demaret E, ed.). IARC Technical Reports No. 32; 1998.</ref> | ||
http://publications.iarc.fr/Book-And-Report-Series/Iarc-Technical-Publications/Standards-And-Guidelines-For-Cancer-Registration-In-Europe-2003]] | http://publications.iarc.fr/Book-And-Report-Series/Iarc-Technical-Publications/Standards-And-Guidelines-For-Cancer-Registration-In-Europe-2003]] | ||
Les dades electròniques sanitàries estan en constant augment. La quantitat i el tipus d’informació disponible actualment és important. Les dades estan codificades amb classificacions internacionals o locals '''('''figura 2''')'''. | Les dades electròniques sanitàries estan en constant augment. La quantitat i el tipus d’informació disponible actualment és important. Les dades estan codificades amb classificacions internacionals o locals '''('''figura 2''')'''. | ||
Per tant és bàsic estandarditzar la informació abans d’iniciar un registre de càncer. Disposar de més fonts d’informació permet detectar més tumors (augmenta la sensibilitat de detecció de tumors) i obtenir altres dades clíniques com els tractaments '''('''figura 2''')'''. Els registres de càncer han de planificar les seves activitats més enllà de la producció d’estadístiques. Els algorismes dels registres automatitzats de càncer poden oferir | Per tant és bàsic estandarditzar la informació abans d’iniciar un registre de càncer. Disposar de més fonts d’informació permet detectar més tumors (augmenta la sensibilitat de detecció de tumors) i obtenir altres dades clíniques com els tractaments '''('''figura 2''')'''. Els registres de càncer han de planificar les seves activitats més enllà de la producció d’estadístiques. Els algorismes dels registres automatitzats de càncer poden oferir estadístiques amb més puntualitat i reduir costos sempre que, paral·lelament, mantinguin el control de qualitat de forma estricta.<ref name=":9" /><ref name=":10" /> | ||
estadístiques amb més puntualitat i reduir costos sempre que, paral·lelament, mantinguin el control de qualitat de forma estricta. | |||
= Fonts d’informació dels RTH de l’ICO-ICS = | = Fonts d’informació dels RTH de l’ICO-ICS = | ||
Revisió del 07:32, 4 maig 2022
Introducció
L’Agència Internacional per a la Investigació sobre el Càncer (IARC) duu a terme un programa de recerca centrat especialment en l’epidemiologia del càncer i l’estudi de possibles agents cancerígens en l’entorn humà. Les publicacions de l’Agència estan disponibles a http://www.iarc.fr/
El projecte European Network of Cancer Registries (ENCR) té com a objectiu principal millorar la qualitat, comparabilitat i disponibilitat de la informació sobre la incidència del càncer a Europa.[1][2] Totes les activitats de l’ENCR estan disponibles a www.encr.com.fr. Els objectius específics són:
- Millorar la qualitat, comparabilitat i disponibilitat de dades d’incidència i mortalitat de càncer, proporcionar informació periòdica sobre la càrrega del càncer i promoure l’ús de registres de càncer de base poblacional (RCBP) per al control del càncer, la planificació i la investigació sanitària a Europa.
- Promoure la col·laboració entre registres de càncer, definir els estàndards de recollida de dades, proporcionar formació per al personal de registres de càncer i distribuir regularment informació sobre la incidència i la mortalitat per càncer a la Unió Europea.
Quan la Comissió Europea va establir el Programa Europa Contra el Càncer, va definir com a objectiu aconseguir informació comparable sobre la càrrega del càncer per avaluar les activitats de control d’aquesta malaltia. Les activitats com la prevenció, la detecció precoç, el tractament, la rehabilitació i la cura pal·liativa són fonamentals en l’atenció al pacient oncològic. La cura del càncer implica el coneixement de quants pacients desenvolupen càncer i quines localitzacions tumorals són les més freqüents. Per avaluar l’eficàcia dels programes de prevenció i detecció precoç i dels tractaments es necessiten les dades dels RCBP. Totes aquestes estadístiques depenen de la qualitat de les dades dels registres, que han de ser comparables, completes i de bona qualitat.[1][2]
Encara que la normativa de l’ENCR està destinada a RCBP, els registres de tumors hospitalaris (RTH) han de recopilar les dades seguint les mateixes directrius que els RCBP. Els RTH tenen com a objectiu principal ajudar en la gestió del càncer al centre hospitalari al qual pertany el registre. Però, tot i així, si hi ha un RCBP a l’àrea geogràfica de l’RTH, s’hauria d’establir un grup de treball entre ambdós registres i és aquí on rau la importància d’estendre la normativa dels registres poblacionals als hospitalaris. Aquest document proporciona les directrius i recomanacions principals més actualitzades elaborades per l’ENCR i pretén ser una eina útil per a les persones que participen en la recollida de dades dels RTH.
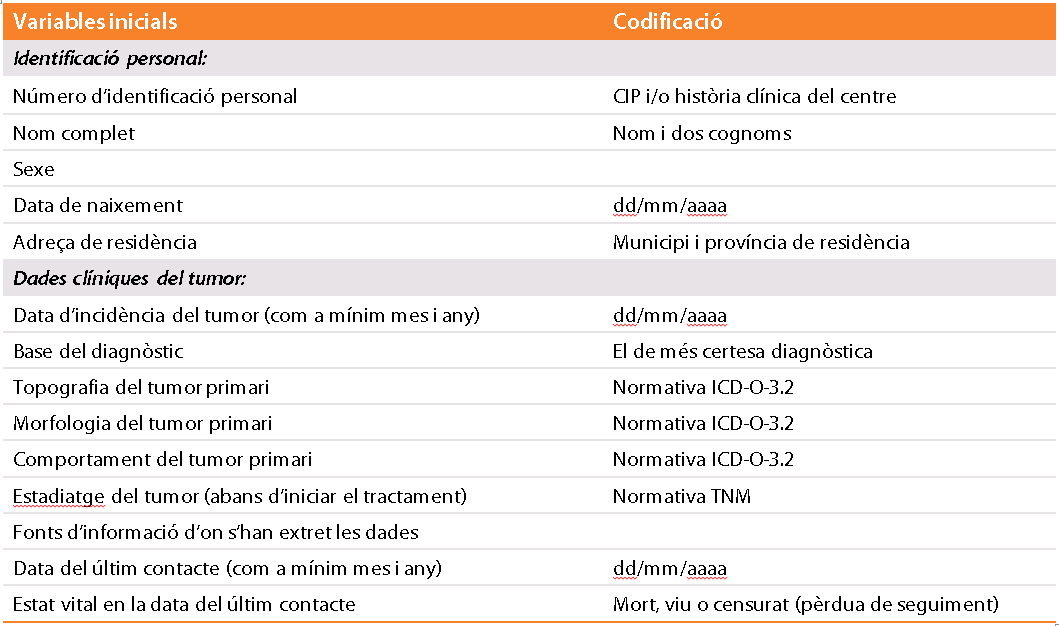
D’acord amb les recomanacions per assegurar la confidencialitat de la informació dels pacients, s’aconsella que els registres de càncer recopilin amb criteris de qualitat les dades que són rellevants per assolir els objectius proposats de manera precisa, completa i actualitzada. Per tant, els registres de càncer han de limitar el nombre de variables per dos motius: qualitat (menys dades que s’han de registrar) i confidencialitat (com més dades es demanen, més possibilitats d’incompliment de la confidencialitat). Les dades mínimes recomanades per emplenar en els registres de càncer són:[3]
Taula 1. Variables mínimes que s’han de recopilar en un registre de càncer[3]
Classificació internacional de malalties per a oncologia (ICD-O)
Els RCBP proporcionen les dades necessàries per a la vigilància del càncer d’una àrea geogràfica determinada[7] i són un model d’integració de dades de salut ja que, d’acord amb les normes internacionals de la IARC, recopilen sistemàticament informació sobre tots els càncers recents diagnosticats d’una àrea geogràfica a partir de múltiples fonts d’informació.[8] Una de les principals fonts de dades són els laboratoris de patologia que durant molts anys han codificat els diagnòstics mitjançant la Systematized Nomenclature of Medicine II (SNOMED II), que ha estat una de les versions de SNOMED més àmpliament utilitzades. Actualment, diversos laboratoris de Catalunya estan en procés de migració a SNOMED CT (SNOMED Clinical Terms).[9][10][11]
The International Classification of Diseases for Oncology (ICD-O) s’utilitza des de l’any 1976 en els RCBP per codificar la topografia i la morfologia de les neoplàsies.[12] Les edicions de la ICD-O de 1990, 2000 i 2011 (ICD-O-2, ICD-O-3.1 i ICD-O-3.2, respectivament)[4][13][14][15][16] van actualitzar la topografia amb la ICD-10[17] i la morfologia amb la World Health Organization’s International Histological of Tumours Series (WHO Blue Books).[18] Aquesta sèrie actualitza i crea nous codis morfològics de la ICD-O per a cada neoplàsia d’acord amb criteris histològics, immunohistoquímics i genètics. Els codis morfològics de neoplàsia oscil·len des de M-8000/0 a M-9992/3. Els primers quatre dígits numèrics indiquen la histologia; el cinquè dígit, el comportament del tumor: benigne (0), incert si és benigne o maligne (1), in situ (2), maligne (3), metastàtic (6) i maligne però incert si la mostra és del tumor primari o d’una metàstasi (9).[12][13][14][15][16]
A partir de l’any 2018, la terminologia SNOMED CT emprada per codificar la topografia i la morfologia en els laboratoris d’anatomia patològica (AP) inclou els conceptes morfològics però no els codis esmentats anteriorment (M-8000/0 a M-9992/3). Per aquest motiu, el Pla director d’oncologia (PDO) ha creat un diccionari de neoplàsies de SNOMED CT i l’ha convertit a la ICD-O.3.2 i a la sèrie WHO Blue Books amb la finalitat d’identificar els casos candidats a ser registrats en un RCBP o RTH sota els criteris de la IARC i l’ENCR.[19]
Introducció a l’automatització dels registres de càncer
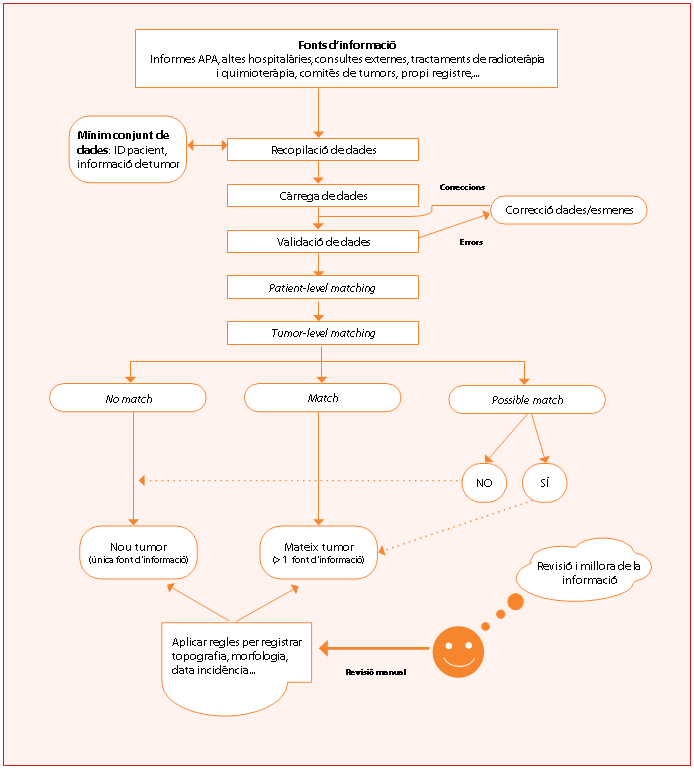
L’automatització és el disseny d’algorismes per substituir part dels processos manuals de presa de decisions del personal dels registres de càncer.[20] La figura 1 il·lustra el flux de dades estàndard de resolució de casos de càncer d’un software d’automatització de registres.[20]
Un registre de càncer només es pot automatitzar si les fonts d’informació (altes hospitalàries, anatomia patològica, quimioteràpia, radioteràpia, mortalitat...) estan disponibles electrònicament.[20] El registre de càncer també ha de ser una font d’informació del registre mateix ja que permet identificar els tumors que ja han estat registrats anteriorment (tumors prevalents).[20] Aquestes fonts d’informació han de proveir el registre de càncer del conjunt mínim de dades necessàries (taula 1).
La integritat i la qualitat de les dades electròniques originals són crucials per determinar l’eficiència de l’automatització del registre de càncer. Una baixa qualitat de les fonts d’informació originals augmenta la proporció de diagnòstics discordants i disminueix l’eficiència de l’automatització atès que augmenta el nombre de casos que cal revisar manualment.[20] Utilitzar múltiples fonts d’informació augmenta els casos que s’han de revisar, però disminueix la probabilitat de generar falsos positius, augmenta l’exhaustivitat i enriqueix la informació del registre.[20][21]
És important adaptar-se al vocabulari emprat en els registres de càncer automatitzats:
- Sumarització (patient level-matching): procés pel qual les fonts d’informació electròniques són vinculades a un mateix individu. S’assigna a cada individu un número identificador intern. En un RTH, el número d’història clínica (HC) s’utilitza per lligar la informació de cada pacient a les diferents bases de dades.[20][21]
- Consolidació (tumor level-matching): els algorismes avaluen les dades de les fonts d’informació per de- terminar quins tumors presenta el pacient i sumaritzar les dades per a cada tumor.[1][2][3][22] No hi ha algorismes estàndard definits, però els registres automatitzats es basen parcialment en els descrits més endavant. Els algoritmes tenen definits possibles motius de revisió que fan que un nombre determinat de casos s’hagin de resoldre manualment. La proporció de casos resolts automàticament oscil·la del 50% al 75% i la variabilitat és més atribuïble a la qualitat de les fonts d’informació que no pas al rendiment dels algorismes.[20][21][23] Els possibles tumors múltiples són, sobretot, la causa principal de revisió (figura 1).[20]
L’automatització dels registres segueix els passos següents: i) recopilar les dades de les fonts d’informació, ii) estandarditzar la informació, iii) agrupar la informació del tumor (consolidació, tumor-level matching), iv) omplir i codificar la topografia i morfologia tumorals segons la ICD-O-3.2.4 Un pacient pot tenir més d’un tumor (tumors múltiples) i la consolidació hauria d’agrupar la informació per a cada tumor (figura 1).
Un tumor pot provenir d’una font d’informació o de més d’una font. Si el tumor no està inclòs en el registre (No match) es considera un tumor nou (incident) i es registra. Si el tumor ja està registrat al registre (Match, cas prevalent) s’actualitzen les dades a partir de les fonts d’informació. Algunes de les variables de la taula 1 s’omplen automàticament sempre que la qualitat de les fonts d’informació ho permeti. La revisió manual millora i valida la informació dels tumors (figura 1).
Figura 1. Flux de dades dels registres de càncer automatitzats
Les dades electròniques sanitàries estan en constant augment. La quantitat i el tipus d’informació disponible actualment és important. Les dades estan codificades amb classificacions internacionals o locals (figura 2).
Per tant és bàsic estandarditzar la informació abans d’iniciar un registre de càncer. Disposar de més fonts d’informació permet detectar més tumors (augmenta la sensibilitat de detecció de tumors) i obtenir altres dades clíniques com els tractaments (figura 2). Els registres de càncer han de planificar les seves activitats més enllà de la producció d’estadístiques. Els algorismes dels registres automatitzats de càncer poden oferir estadístiques amb més puntualitat i reduir costos sempre que, paral·lelament, mantinguin el control de qualitat de forma estricta.[20][21]
Fonts d’informació dels RTH de l’ICO-ICS
Introducció al software ASEDAT
Definició de cas. Criteris d’inclusió de l’RTH de l’ICO-ICS
Definició de cas
Definició de tumors múltiples: normes de registre
Referències bibliogràfiques
- ↑ 1,0 1,1 1,2 1,3 International Agency for Research on Cancer. Standards and Guidelines for Cancer Registration in Europe. The ENCR Recommendations. Vol I. (Tyczynski J, Démaret E, Parkin D, ed.). IARC Technical Publication No. 40; 2003. http://www.+iarc.fr/en/publications/pdfs-online/treport-pub/treport-pub40/index.php
- ↑ 2,0 2,1 2,2 Martos C, Crocetti E, Visser O, Rous B, Cancer Data Quality Checks Working Group. A Proposal on Cancer Data Quality Checks : One Common Procedure for European Cancer Registries. European Network of Cancer Registries; 2018. doi:10.2760/429053
- ↑ 3,0 3,1 3,2 International Agency for Research on Cancer, World Health Organization, International Association of Cancer Registries. Cancer Registration: Principles and Methods. (Jensen O, Parkin D, Maclennan R, Muir C, Skeet R, ed.). IARC Scientific Publications No, 95; 1991. https://publications.iarc.fr/Book-And-Report-Series/Iarc-Scientific-Publications/+Cancer-Registration-Principles-And-Methods-1991
- ↑ 4,0 4,1 International Classification of Diseases for Oncology (ICD-O) - 3rd edition, 2nd revision. http://www.iacr.com.fr/+index.php?option=com_content&view=category&layout=blog&id=100&Itemid=577
- ↑ International Union Against Cancer (UICC). TNM Classification of Malignant Tumours, Seventh Edition. (Sobin L, Gospodarowicz MK, Wittekind C, ed.). John Wiley & sons, Ltd.; 2009.
- ↑ Union for International Cancer Control (UICC). TNM Classification of Malignant Tumours, Eighth Edition. (Brierley JD, Gospodarowicz MK, Wittekind C, ed.). John Wiley & sons, Ltd.; 2017.
- ↑ Siesling S, Louwman WJ, Kwast A, et al. Uses of cancer registries for public health and clinical research in Europe: Results of the European Network of Cancer Registries survey among 161 population-based cancer registries during 2010 – 2012. Eur J Cancer. 2015;51(9):1039-1049.
- ↑ Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136(5):E359-E386.
- ↑ College of American Pathologists. Committee on nomenclature and Classification of Disease, American Cancer Society, American Medical Association. Systematized Nomenclature of Pathology. 1st ed.; 1965.
- ↑ College of American Pathologists, Committee on nomenclature and Classification of Disease. Systematized Nomenclature of Medicine. College of American Pathologists; 1976.
- ↑ García-Rojo M, Daniel C, Laurinavicius A. SNOMED CT in pathology. Stud Health Technol Inform. 2012;179:123-140.
- ↑ 12,0 12,1 World Health Organization. International Classification of Diseases for Oncology. 1st ed.; 1976.
- ↑ 13,0 13,1 World Health Organization. International Classification of Diseases for Oncology. Third Edition. First Revision. (Fritz A, Percy C, Jack A, et al., ed.).; 2013. https://apps.who.int/iris/handle/10665/42344
- ↑ 14,0 14,1 Percy C, Van Holten V, Muir C, ed. International Classification of Diseases for Oncology. 2nd ed. World Health Organization; 1990.
- ↑ 15,0 15,1 Fritz A, Percy C, Jack A, et al., ed. International Classification of Diseases for Oncology. 3rd ed. Wold Health Organization; 2000.
- ↑ 16,0 16,1 Fritz A, Percy C, Jack A, et al., ed. International Classification of Diseases for Oncology (ICD-O) - 3rd Edition, 1st Revision. 3rd. Wold Health Organization; 2013. https://apps.who.int/iris/handle/10665/42344
- ↑ World Health Organization. International Statistical Classification of Diseases and Related Health Problems. Tenth Revision. Published online 1992:Vols 1-3.
- ↑ International Agency for Research on Cancer, World Health Organization. WHO Classification of Tumours. IARC, Lyon. Published 2018. Accessed June 6, 2018. https://whobluebooks.iarc.fr/
- ↑ Sanz X, Pareja L, Rius A, et al. How cancer registries can detect neoplasms in pathology laboratories that code with SNOMED CT terminology? An actual, simple and flexible solution. Int J Med Inform. 2020;141(July 2019):104167. doi:10.1016/j.ijmedinf.2020.104167
- ↑ 20,00 20,01 20,02 20,03 20,04 20,05 20,06 20,07 20,08 20,09 20,10 International Agency for Research on Cancer, European Network of Cancer Registries, Europe Against Cancer Programme of The European Commission. Automated Data Collection in Cancer Registration. (Black R, Simonato L, Storm H, Demaret E, ed.). IARC Technical Reports No. 32; 1998.
- ↑ 21,0 21,1 21,2 21,3 Simonato L, Zambon P, Rodella S, et al. A computerised cancer registration network in the Veneto region, north-east of Italy: a pilot study. Br J Cancer. 1996;73(11):1436-1439.
- ↑ International Agency for Research on Cancer, World Health Organization, International Association of Cancer Registries, European Network of Cancer Registries. International Rules for Multiple Primary Cancers (ICD-O Third Edition). International Agency for the Research on Cancer; 2004. http://www.iacr.com.fr/images/doc/MPrules_+july2004.pdf
- ↑ Ribes J, Gálvez J, Melià A, Clèries R, Messeguer X, Bosch FX. Automatización de un registro hospitalario de tumores. Gac Sanit. 2005;19(3):221-228.